中科院自动化研究所、中科院分子影像重点实验室田捷研究员团队,与北京大学肿瘤医院季加孚院长团队、郑州大学第一附属医院高剑波院长团队、镇江市第一人民医院医学影像科单秀红主任团队和云南省肿瘤医院放射科团队,开展了基于CT影像组学的胃癌隐匿性腹膜转移的多中心、回顾性临床研究,取得了诊断效果的显著突破,相关研究工作发表于临床肿瘤权威期刊Annals of Oncology(2019, DOI:10.1093/annonc/mdz001,影响因子13.930,中科院JCR医学1区Top)。
胃癌是我国的高发癌种,全球约有一半的胃癌新发和死亡病例集中在我国,这给我国带来了巨大的社会和经济负担。胃癌发生远处转移是导致胃癌患者死亡的主要原因之一,据统计胃癌远处转移病例中的53%-66%为胃癌邻近的腹膜转移,存在腹膜转移的胃癌患者属于不可根治的范畴,手术已经无法延长患者的生存期,美国NCCN指南、中国CSCO指南、欧洲ESMO指南都不推荐进行手术治疗,因此,术前准确判断腹膜转移情况可有效辅助胃癌的治疗决策和避免不必要的手术。目前CT影像是常见的诊断腹膜转移的术前无创手段,影像科医生通常通过CT上观察到的大量腹水、明显腹膜增厚、以及网膜饼征来判断腹膜转移,但临床上存在很多隐匿性腹膜转移的患者,其在术前CT诊断上观察不到明显的腹膜转移征象,这些患者很容易被漏诊,而产生错误的治疗决策,如在开腹手术过程中才发现腹膜转移而不得不终止手术,或手术后因腹膜转移病灶复发而影响患者的预后。因此,早期诊断胃癌隐匿性的腹膜转移具有重大的临床价值。
针对这一挑战性的临床问题,中科院分子影像重点实验室通过多项技术创新,将影像组学应用于胃癌隐匿性腹膜转移的预测研究中,该研究基于胃癌原发灶和邻近腹膜的定量CT影像组学特征,并结合术前的Lauren分型,有效预测了胃癌患者的隐匿性腹膜转移。具体来说该研究从北京大学肿瘤医院、郑州大学第一附属医院、镇江市第一人民医院和云南省肿瘤医院等4家医院收集554例术前CT诊断为腹膜转移阴性的患者的影像和临床数据,其中122例经腹腔镜探查病理证实为腹膜转移阳性,这些患者通常为临床漏诊的病人,432例证实为腹膜转移阴性。该研究基于患者静脉期CT影像中胃癌最大层面的原发灶图像和病灶邻近的一块腹膜图像,提取266个定量影像组学特征,通过分析发现2个原发灶影像特征和2个腹膜影像特征,以及1个临床因素Lauren分型与腹膜转移具有显著性的相关性,将这些特征结合构建一个影像组学预测模型(如图1所示),在4家医院的验证集上都取得了很好的预测效果,AUC均达到0.92以上,特别是针对CT漏诊的隐匿性腹膜转移患者,该模型有非常高的检出率。
以往研究通常关注腹膜影像本身,而该研究发现胃癌的腹膜转移与胃癌原发灶和腹膜两者同时相关,这从侧面验证了肿瘤转移经典的‘土壤-种子学说’(图2所示),即肿瘤转移不仅与肿瘤细胞本身(种子)相关,还与转移区域的微环境(土壤)相关。该研究还发现反映腹膜影像异质性的特征具有较好的预测性能,这可能反映了早期腹膜转移的一些细微的、不易被人眼发现的征象改变,而影像组学通过深入挖掘影像数据,可以定量提取这些细微征象,辅助医生诊断胃癌腹膜转移。
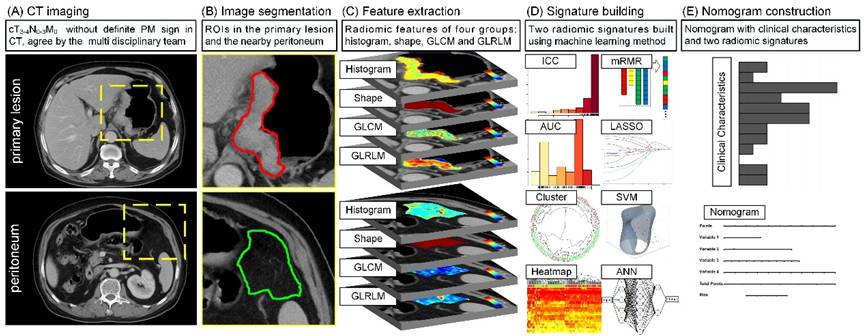
图1. 隐匿性腹膜转移预测模型构建流程。(A) 收集影像数据;(B)病灶和腹膜分割;(C)影像组学特征提取;(D)影像组学标签构建;(E)影像组学模型构建。
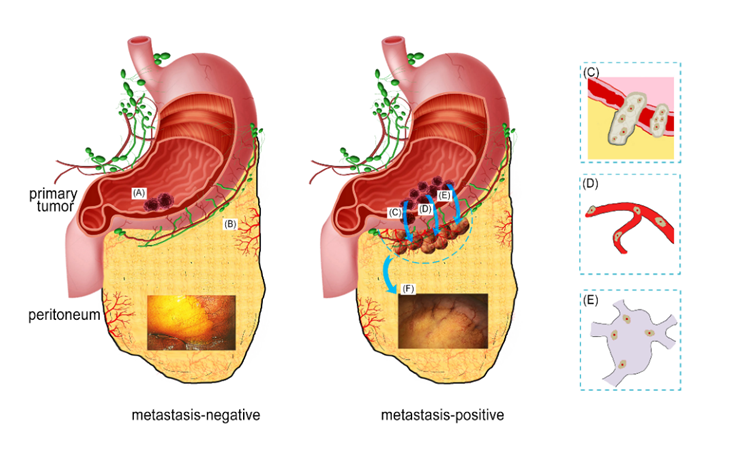
图2. 胃癌腹膜转移过程示意图。(A)胃癌原发病灶形成;(B)改变腹膜区域微环境;(C)肿瘤细胞通过脱落转移;(D) 肿瘤细胞通过血液循环转移;(E) 肿瘤细胞通过淋巴循环转移;(F)形成腹膜转移灶。
本文由中国科学院分子影像重点实验室的董迪副研究员作为第一作者,唐磊(北京肿瘤医院)、李子禹(北京肿瘤医院)、方梦捷博士生(分子影像重点实验室)、高剑波(郑大一附院)和单秀红(镇江第一医院)为并列第一作者,田捷研究员和季加孚院长(北京肿瘤医院)为并列通讯作者。该研究得到了国家自然科学基金、科技部重点研发计划、北京市科委项目、中科院青促会等项目的资助。
论文下载链接: https://academic.oup.com/annonc/advance-article/doi/10.1093/annonc/mdz001/5299442?searchresult=1
