中科院自动化研究所、中科院分子影像重点实验室田捷研究员团队针对小动物活体的生物自发光断层成像(Bioluminescence Tomography)重建精度较差的挑战性科学问题,开展了基于人工智能技术的新型成像方法研究并获取了突破性进展。新型人工智能光学分子影像三维成像技术,将小鼠颅内脑胶质瘤的三维定位精度,由传统方法的百微米级误差缩小到了十微米级。相关研究由中科院分子影像重点实验室的高源(博士研究生)和王坤(副研究员)为并列第一作者,由王坤和田捷(研究员)为并列通讯作者,发表于光学领域内的顶级期刊Optica(2018; 5(11): 1451-1454。影像因子7.536,中科院大类物理1区、小类光学1区)。
生物自发光断层成像可以高特异性、定量可视化荷瘤动物体内肿瘤细胞的三维分布,是在活体动物上开展肿瘤基础研究的一项重要影像学工具。然而,由于光子在生物体内具有非均匀化的高散射和高吸收的物理特性,通过探测动物体表的发光光斑来逆向重建出生物体内的光源位置(即肿瘤位置),是一项极具挑战性的工作。传统方法是通过构建扩散近似方程来描述光子在生物体内的传播过程,再通过逆向求解该方程获取光源在动物体内的三维分布,即所谓的前向模型和逆向求解。然而,这一方法具有两大局限:前向模型难以精确描述光子在生物体内的传播,具有误差;逆向求解的方程具有严重的病态性,也会带来误差。两种误差叠加在一起具有放大效果,最终导致光学断层成像对于动物体内肿瘤的三维定位具有数百微米到1毫米的误差。这显著限制了科研人员对于早期微小肿瘤的检测和研究。
中科院分子影像重点实验室团队摒弃了传统成像方法的思路,提出基于机器学习的新型人工智能重建:完全舍弃构建前向模型去描述光子在生物体内的传播,而是通过构建大量的仿真数据集,在仿真数据上确定动物体表的光斑和体内的光源,再通过该数据集训练计算机智能化学习体表光斑和体内光源的非线性关系,从而构建出适用于生物自发光断层成像的人工智能模型,最终三维重建活体动物荷瘤模型内的肿瘤三维分布。这一方法直接避免了传统方法的前向模型误差和逆向求解误差,因此有望显著提高成像精度。
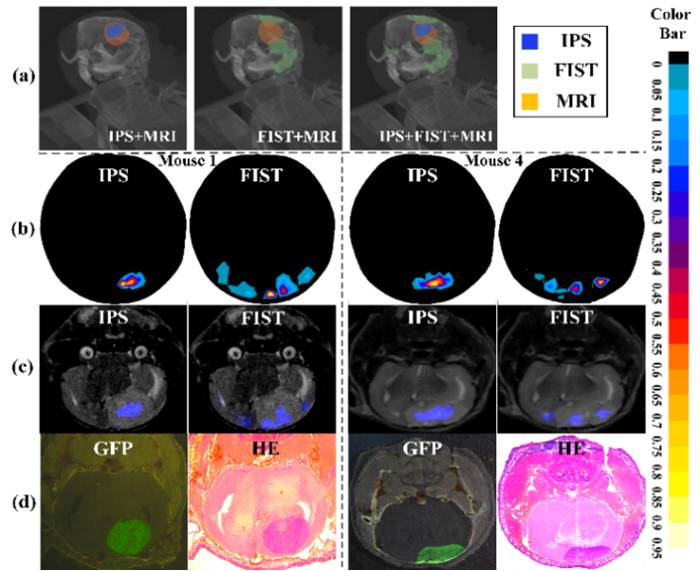
基于这一新型思路,该团队通过自主研发的MOSE光学仿真平台,提出一种新型的仿真数据构建方法,人工构建了近8000例的原位脑胶质瘤荷瘤小鼠;并基于这一数据库,构建了一种新型的机器学习方法。我们把该仿真数据构建加机器学习重建的策略统一称之为MP-IPS方法(Multilayer Perceptron-based Inverse Problem Simulation)。在人工智能模型通过该方法训练和构建完成后,研究团队构建了数十只原位脑胶质瘤荷瘤小鼠的动物模型,并对该批动物分别进行了CT-MRI-光学三个成像模态的图像扫描。通过MP-IPS方法和传统方法,分别对每只小鼠进行了生物自发光断层成像的三维可视化重建(如下图)。最终结果表明,新型人工智能方法对于脑胶质瘤的三维定位误差均小于80微米,而传统方法的定位误差为350微米以上。该项研究揭示了人工智能在提高生物医学成像的成像精度上,具有显著的优越性和应用潜力,为疾病动物模型乃至临床患者的影像学研究提供了全新的思路。